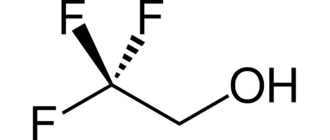
Этиленхлоргидрин — хлорорганическое соединение с формулой HOСН2—CH2Cl. Принадлежит к бифункциональным соединениям. Широко используется в органическом синтезе. Весьма токсичен. Относится ко II классу опасности.
| Этиленхлоргидрин | |
|---|---|
| Общие | |
| Систематическое наименование |
2-хлорэтанол |
| Традиционные названия | этиленхлоргидрин, β-хлорэтиловый спирт, хлоргидрин этиленгликоля |
| Хим. формула | C2H5OCl |
| Физические свойства | |
| Состояние | бесцветная вязкая жидкость, с приятным запахом |
| Молярная масса | 80,52 г/моль |
| Плотность | 1,205 |
| Энергия ионизации | 10,9 ± 0,1 эВ |
| Термические свойства | Температура |
| • плавления | -69 |
| • кипения | 128,7 °C |
| • вспышки | 140 ± 1 °F |
| Пределы взрываемости | 4,9 ± 0,1 об.% |
| Давление пара | 11 мм. рт ст. (20 °С) |
| Химические свойства | |
| Константа диссоциации кислоты
Реакция обмена Происходит с участием солей щелочных металлов: где Ме — Na, K, X — F, Br, CN. При этом реакция обмена хлора на фтор и бром протекает в растворе этиленгликоля при повышенной температуре; реакция обмена атома хлора на нитрильную группу идёт в присутствии катализатора — цианистой меди (CuCN). ПолучениеВ лабораториях этиленхлоргидрин получают нагреванием этиленгликоля с хлористым водородом: 2-хлорэтанол может быть получен реакцией этилена с хлорноватистой кислотой в водной среде:
Этот способ получения этиленхлоргидрина применяется в промышленности. Взаимодействие этиленоксида с хлористым водородом приводит к образованию этиленхлоргидрина, реакция сопровождается выделением тепла: Также существует способ синтеза путём кипячения этиленгликоля с однохлористой серой, последующей фильтрацией смеси и ректификацией: ПрименениеПрименяется как растворитель в органическом синтезе (растворяет ацетилцеллюлозу). Также применяется при синтезе оксирана
тиодигликоля некоторых красителей, эпоксидных смол, пестицидов и лекарств, в том числе производных холина. Он же применяется в получении этиленгликоля и его производных, в частности динитрогликоля. Этиленхлоргидрин является также сырьём для получения иприта по реакции Мейера. Этиленхлоргидрин является сырьём для получения этаноламинов, которые широко применяются при очистке технических газов от кислых примесей и в производстве моющих средств. Впервые промышленное применение этиленхлоргидрина было осуществлено для получения синтетического индиго. Токсикология и безопасностьОбщий характер действия. Сильный яд, действующий на нервную систему, обмен веществ, вызывает поражение паренхиматозных органов, раздражает слизистые оболочки, легко проникает через кожу. Особую опасность представляют пары этиленхлоргидрина. Токсическое действиеИзвестно, что смертельно вдыхание концентрации 1—1,2 мг/л. при 2-часовой экспозиции. Головокружение и рвота, через несколько часов жжение в глазах, слабость, понос, сильная жажда, боль в области сердца, смерть в первые же сутки. Описано внезапное тяжёлое отравление после длительной работы в контакте с этиленхлоргидрином. Возникли рвота, коматозное состояние, цианоз, нарушение дыхания и понижение сухожильных рефлексов. Состояние улучшилось после введения раствора глюкозы и левулёзы, гидрокортизона, бикарбоната натрия, глюконата кальция. Выздоровление через неделю. Действие на кожуОбладает слабым раздражающим эффектом. Хорошо впитывается через кожу. Известны лёгкие и тяжёлые отравления человека через кожу. При попадании этиленхлоргидрина на 1/4 поверхности кожного покрова через 1 час тяжёлая рвота, чувство опьянения, через 5 часов нарушение сознания, исчезнувшее лишь после 6 суток лечения. БезопасностьВзрыво- и пожароопасный продукт, т. всп. 55 °С, т. воспл. (в закрытом приборе) 58,9 °С, т. самовоспл. 425 °С; КПВ 4,9-15,9% (по объёму). Предельно допустимая концентрация 1 мг/м3. Индивидуальная защита. Меры предупреждения. Определение в воздухеОсновано на гидролизе этиленхлоргидрина до этиленгликоля и окислении последнего до формальдегида. Метод не специфичен в присутствии формальдегида, окиси этилена и этиленгликоля. Определению не мешают хлор, НСl, дихлорэтан, хлорекс. Чувствительность 0,5 мкг в анализируемом объёме. | |