Нитротолуолы — органические соединения, нитропроизводные толуола, с общей формулой СН3С6Н5-n(NO2)n, где n = 1, 2, 3.
Номенклатура
- Мононитротолуолы — три изомера по положению заместителя — нитрогруппы:
-

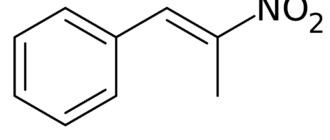
2-нитротолуол
(о-нитротолуол, орто-) -

3-нитротолуол
(м-нитротолуол, мета-) -

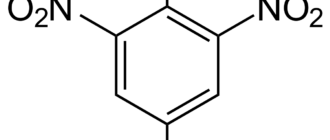
4-нитротолуол
(п-нитротолуол, пара-)
- Динитротолуолы — шесть изомеров по положению заместителей — нитрогрупп:
-

2,3-динитротолуол
-

2,4-динитротолуол
-

2,5-динитротолуол
-

2,6-динитротолуол
-

3,4-динитротолуол
-

3,5-динитротолуол
- Тринитротолуолы — шесть изомеров по положению заместителей — нитрогрупп:
-

2,3,4-тринитротолуол
-

2,3,5-тринитротолуол
-

2,3,6-тринитротолуол
-

2,4,5-тринитротолуол
-

2,4,6-тринитротолуол
-

3,4,5-тринитротолуол
- Тетранитротолуол имеет 3 изомера.
Получение
- Прямым нитрованием толуола можно присоединить одну, две или три нитрогруппы. Тетранитротолуолы можно получить лишь непрямыми способами. Присутствие метильной группы существенно облегчает процесс нитрования по сравнению с бензолом.
- В промышленности нитротолуолы получают жидкофазным нитрованием толуола нитрующей смесью (55-66 % H2SO4, 28-32 % HNO3 и 12-20 % Н2О) по непрерывной технологии. Продукт нитрования содержит обычно 55-60 % 2-нитротолуола, 3-4 % 3-нитротолуола и 35-40 % 4-нитротолуола, которые выделяют после отгонки с паром избытка толуола и высушивании остатка. 4-Нитротолуол вымораживают, а 2- и 3-нитротолуолы разделяют перегонкой в вакууме.
- Технический динитротолуол получают нитрованием технического мононитротолуола нитрующей смесью при 70-80°С. Продукт состоит из 2,4- и 2,6-изомеров (соотв. 75 и 20 %). Обычно их используют без разделения изомеров для получения тринитротолуола.
- Из тринитротолуолов практический интерес представляет 2,4,6-тринитротолуол — широко используемое взрывчатое вещество. Впервые был получен в 1863 году Юлиусом Вильбрандом. В 1891 году началось промышленное производство в Германии. В промышленности получают непрерывным противоточным нитрованием. От несимметричных изомеров, динитропроизводных, следов тетранитрометана очищают обработкой водным раствором сульфита натрия Na2SO3 или перекристаллизацией из горячего спирта (1:3) или толуола.
Физические свойства
| Изомер | Молекулярная масса, г/моль |
Внешний вид | Тплав. °С |
Ткип. °С |
Плотность, г/см³ |
Растворимость, г/100 г р-рителя |
|---|---|---|---|---|---|---|
| 2-нитротолуол | 137,15 | желтоватая жидкость | -10,6; -9,55метаст.; -4,1; -3,85 |
219-219,5; 222-223 | 1,1629 | Бесконечно в этаноле и эфире |
| 3-нитротолуол | желтоватая жидкость | 15,5-16 | 231 | 1,1571 | Легко растворим в этаноле и эфире | |
| 4-нитротолуол | бесцветные ромбические иглы | 51,4; 54,5 | 238 | 1,2860 | Легко растворим в этаноле и эфире | |
| 2,3-динитротолуол | 182,14 | иглы | 63 | |||
| 2,4-динитротолуол | желтые иглы | 69,5-70,5 | 300разл. | 1,521 | в эфире 9,4 | |
| 2,5-динитротолуол | иглы | 50,5; 52,5 | 1,282 | Легко растворим в этаноле | ||
| 2,6-динитротолуол | ромбические иглы | 61; 66 | 1,283 | Растворим в этаноле | ||
| 3,4-динитротолуол | желтые иглы | 59,8 | 1,259 | Растворим в этаноле и эфире | ||
| 3,5-динитротолуол | желтые иглы | 93 | возгоняется | 1,277 | Растворим в этаноле и эфире | |
| 2,3,4-тринитротолуол | 227,14 | призмы | 112 | 290-310взрыв. | 1,620 | Легко растворим в эфире |
| 2,3,5-тринитротолуол | 92.5 | 1,620 | ||||
| 2,3,6-тринитротолуол | 109.8 | 1,620 | ||||
| 2,4,5-тринитротолуол | желтые ромбические пластинки | 104 | 290-310взрыв. | 1,620 | Легко растворим в эфире | |
| 2,4,6-тринитротолуол | бесцветные многогранники | 80,7 | 240взрыв. | 1,654 | в эфире 3,33; в ацетоне 109 | |
| 3,4,5-тринитротолуол | 132.0 | 313разл. | 1,620 |
Химические свойства
- Мононитротолуолы при окислении КМnО4, К2Сr2О7 или МnО2 в кислой среде образуют соответствующие нитробензойные кислоты. При электрохимическом окисление (в СН3СООН или Н2SО4) — нитробензальдегиды.
- При кипячении с раствором КОН 2-нитротолуол диспропорционирует до 2-аминобензойной (антраниловой) кислоты.
- Восстановление металлами в кислой среде (для 3-нитротолуола также в нейтральной и щелочной средах) приводит к образованию толуидинов, действие Fe или Zn в щелочной среде — к азо-, азокси- и гидразосоединениям.
Применение
- 2- и 4-нитротолуолы применяют в синтезе толуидинов, хлорнитротолуолов, нитротолуолсульфокислот, нитротолуолсульфохлоридов, основных красителей,
- 2-Нитротолуол — реагент для обнаружения и фотометрического определения различных окислителей (Сl2, N03-, NO-2, Au(III), Cr(VI), Cu(II), Cu(III)), а также HCN в воздухе.
- 4-Нитротолуол — получение 4-нитробензойной кислоты, в производстве гербицидов и каучуков. Применяется в качестве летучего маркера пластических взрывчатых веществ для облегчения обнаружения в целях борьбы с терроризмом согласно Конвенции о маркировке пластических взрывчатых веществ.
- Динитротолуолы используются в органическом синтезе, красках, взрывчатых веществах, и как топливные добавки.
- 2,4,6-Тринитротолуол является одним из наиболее широко применяемых в военном деле и промышленности взрывчатых веществ.
Токсичность
- Нитротолуолы токсичны, всасываются через кожу, окисляют гемоглобин крови в метгемоглобин, вызывают анемию, отрицательно влияют на центральную нервную систему, функцию почек и печени. Для всех мононитротолуолов ПДК 3 мг/м³, ЛД50 1,46-1,68 г/кг (мыши, перорально). Для динитротолуолов ПДК 1 мг/м³, ЛД50 0,5-0,8 г/кг (мыши, перорально).
- При остром отравлении любым из изомеров — двигательное возбуждение, затем заторможенность, нарушение координации движений, клонико-тонические судороги, слюнотечение, акроцианоз, вздутие кишечника.
- Лица, контактирующие с нитротолуолом в условиях производства, жаловались на головную боль, изжогу, повышенную утомляемость, гипергидроз.