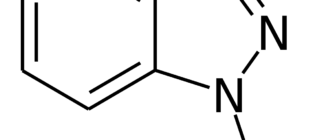
Люминол — органическое соединение с формулой C8H7N3O2. Представляет собой белые или светло-жёлтые кристаллы. Хорошо растворим в полярных органических растворителях, однако практически нерастворим в воде. Люминол является веществом, способным к хемилюминесценции. Он испускает синее свечение при взаимодействии с некоторыми окислителями. Люминол используется судебными экспертами для выявления следов крови, оставленных на месте преступления, так как он реагирует с железом, содержащимся в гемоглобине крови. Также люминол используют биологи при проведении различных исследований клеток для обнаружения меди, железа и цианидов.
|
Люминол
|
|
|---|---|
 |
|
|
Общие
|
|
| Систематическое наименование |
5-амино-2,3-дигидро-1,4-фталазиндион
|
| Традиционные названия | o-Аминофталоил гидразид |
| Хим. формула | C₈H₇N₃O₂ |
|
Физические свойства
|
|
| Состояние | белые или бледно-жёлтые кристаллы |
| Молярная масса | 177,16 г/моль |
|
Термические свойства
|
|
| Т. плав. | 319—320 ℃ |
|
Химические свойства
|
|
| Растворимость в воде | нерастворим |
| Растворимость в этаноле | растворим |
|
Классификация
|
|
| Номер CAS | 521-31-3 |
| PubChem | 10638 |
| ChemSpider | 10192 |
| Номер EINECS | 208-309-4 |
|
SMILES
|
|
|
C1=CC2=C(C(=C1)N)C(=O)NNC2=O
|
|
|
InChI
|
|
|
1S/C8H7N3O2/c9-5-3-1-2-4-6(5)8(13)11-10-7(4)12/h1-3H,9H2,(H,10,12)(H,11,13)
|
|
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Получение
В лабораторных условиях люминол может быть получен в результате двустадийного синтеза исходя из 3-нитрофталевой кислоты. Первой стадией является её нагревание с гидразином в высококипящем органическом растворителе, таком как, например, триэтиленгликоль. В результате реакции конденсации образуется гетероциклическая система 5-нитрофталилгидразида. Нитрогруппа этого соединения может быть восстановлена при помощи NaHSO3 или сульфида аммония, дав в результате люминол.

Многие сайты пишут, что впервые люминол был синтезирован в Германии в 1902 году. В действительности люминол открыт приблизительно в 1853 году. Изучен был в 1928.
Хемилюминесценция

Хемилюминесценция люминола
Хемилюминесцентные свойства люминола проявляются в присутствии окислителей. Для этой цели может быть использован пероксид водорода (H2O2) в растворе щёлочи.
В присутствии катализаторов, таких как соли железа (например, красная кровяная соль), пероксид водорода разлагается с образованием кислорода и воды.
При взаимодействии люминола с гидроксид-ионами образуется дианион, который взаимодействует с кислородом. Продуктом этой реакции является крайне нестабильный органический дирадикал, который моментально распадается с образованием азота и молекулы 3-аминофталевой кислоты в возбуждённом электронном состоянии. При возвращении молекулы из возбуждённого в основное электронное состояние испускается фотон.