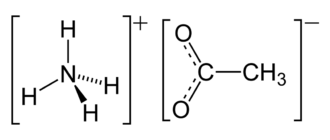
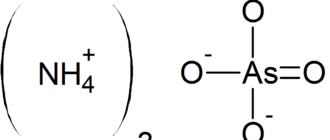Соли аммония — соли, содержащие аммоний, NH4+; по строению, цвету и другим свойствам похожи на соответствующие соли натрия. Все соли аммония хорошо растворимы в воде кроме метаванадата аммония NH4VO3 и триметаванадата аммония3V3O9 и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются.
Применение
- Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотные удобрения и для изготовления взрывчатых веществ — аммонитов;
- Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
- Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
- Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии, в медицине.
Химические свойства солей аммония
- Сильные электролиты, диссоциируют в водных растворах:
При нагревании разлагаются:
- если кислота летучая
- если анион проявляет окислительные свойства
- c солями:
Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты):
При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония):
Получение
Получают соли аммония при взаимодействии аммиака или гидроксида аммония с кислотами:
Реакция аммиака с хлором — качественная реакция на хлор: