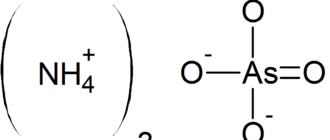Аммоний — полиатомный катион с химической формулой NH4+. Аммоний с анионами образует соли аммония, аммониевые соединения, последние входят в большой класс ониевых соединений. Ион аммония NH4+ является правильным тетраэдром с азотом в центре и атомами водорода в вершинах тетраэдра. Размер иона — 1, 43 Å.
Существует также короткоживущий свободный радикал аммония с формулой NH4 .
Диссоциация солей аммония
При диссоциации солей аммония в водных растворах образуется катион аммония, например:
Свойства солей аммония
Большинство солей аммония — бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением газов.
- Прочность солей аммония сильно различается. Чем сильнее кислота HX, тем более устойчива соль аммония. Так, соль сильной соляной кислоты хлорид аммония NH4Cl вполне стабилен при комнатной температуре, а соль слабой угольной кислоты карбонат аммония (NH4)2CO3 в этих условиях заметно разлагается.
Аммониевые соли летучих кислот при нагревании разлагаются, выделяя газообразные продукты, которые при охлаждении вновь образуют соль:
Если соль образована нелетучей кислотой, то нагревание протекает с разложением аммонийной соли:
- Если анион соли аммония содержит атом-окислитель, то при её нагревании происходит реакция внутримолекулярного окисления-восстановления, например:
- Восстановительные свойства аммония используются во взрывчатых веществах, например аммоналах.
Реакция обнаружения аммония
Реакция для обнаружения аммония — выделение аммиака при действии едких щелочей на соли аммония:
Широко используется для спектрофотометрического количественного анализа также реакция с реактивом Несслера.
«Свободный аммоний»
При взаимодействии раствора хлорида аммония с амальгамой натрия образуется «амальгама аммония» — тестообразная масса, выделяющая водород и аммиак.
При действии NH4I на синий раствор металлического натрия в жидком аммиаке наблюдается обесцвечивание, которое может быть интерпретировано как образование «свободного аммония»:
Заметное разложение этого раствора с выделением водорода идет при температурах выше −40 °C, образовавшаяся бесцветная жидкость легко присоединяет иод (предположительно — по схеме:
однако существование свободного радикала NH4 в этом случае сомнительно, в 1960-х годах предполагалось, что в этом растворе присутствуют сольватированные аммиаком атомы водорода H•NH3.
Замещённые соединения аммония
Органические
Атомы водорода в аммонии могут быть замещены на органические радикалы. Существуют соединения одно-, двух-, трёх- и даже четырёхзамещённого аммония. Гидроксиды четырёхзамещённого аммония (например, гидроксид тетраметиламмония) могут быть выделены в свободном состоянии и являются намного более сильными щелочами, чем сам аммоний и его производные меньшей степени замещения.
Неорганические
Тетрафтораммоний [NF4]+ представляет собой аммоний, все четыре атома водорода в котором замещены фтором. Тетрафтораммоний является одним из немногих соединений, в которых азот имеет степень окисления +5, является сильнейшим окислителем и устойчив только в соединении с комплексными фтористыми анионами, например, тетрафторборатом [BF4]−.