Органические фосфаты — сложные эфиры ортофосфорной кислоты с общей формулойnP(O)(OH)3 − n, где R — углеводородный радикал, n = 1—3.
Номенклатура
Название органических фосфатов составляется из названий органических радикалов, входящих в состав молекулы, и окончания «-фосфат». Кислые органические фосфаты также называются органил- и диорганилфосфорными кислотами:
- (CH3O)P(O)(OH)2 — метилфосфат (метилфосфорная кислота);
- (CH3O)2P(O)OH — диметилфосфат (диметилфосфорная кислота);
- (CH3O)3PO — триметилфосфат.
Физические и химические свойства
Органические фосфаты, у которых в молекуле присутствуют низшие алифатические заместители R, являются жидкостями, фосфаты с высшими заместителями представляют собой масла или кристаллические вещества. Они растворимы в спиртах, хлороформе, ряде полярных органических растворителей. Вторичные и третичные органические фосфаты могут быть растворимы в бензоле, простых эфирах, хлорированных углеводородах.
Термическая устойчивость органических фосфатов увеличивается при переходе от алкильных заместителей к арильным: алкил(арил)фосфаты начинают разлагаться при температурах ~150 °C, триарилфосфаты устойчивы до температур 300—350 °C. Термолиз фосфатов сопровождается отщеплением алкенов, при этом распад триалкилфосфатов ускоряется в присутствии кислот:
При наличии алкильных заместителей с разветвлённой углеродной цепью термическая стабильность понижается, но при отсутствии атомов водорода в β-положении термостабильность значительно возрастает.
Кислые фосфаты также способны диспропорционировать при нагревании и хранении:
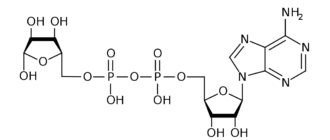
Кислые органические фосфаты проявляют более кислотные свойства, чем фосфорная кислота. Алкил- и арилфосфаты при комнатной температуре и в нейтральной среде не гидролизуются. Гидролиз кислых фосфатов ускоряется при pH < 7, гидролиз полных фосфатов — при pH > 7. Бициклофосфаты очень устойчивы термически и гидролитически, в то время как биоэнергетические фосфаты (например, аденозинтрифосфат) способны гидролизоваться с очень высокой скоростью.
Органические фосфаты реагируют со спиртами в жёстких условиях, образуют стабильные аддукты с соединениями бора BHal3, B(OR)3, способны образовывать комплексы с рядом металлов (U, Pu, Np, Zr, Th, Ce).
Получение и применение
Синтез органических фосфатов заключается в ступенчатой реакции оксихлорида фосфора с соответствующими спиртами и фенолами, а также с их солями (алкоголятами и фенолятами):
Кислые фосфаты можно получать также реакцией спиртов с пентаоксидом фосфора P2O5, при этом в зависимости от соотношения реагентов образуются разные продукты.
К промышленным способам синтеза органических фосфатов относятся:
- реакция фосфора или трихлорида фосфора со спиртами;
- реакция пентаоксида фосфора с диэтиловым эфиром под давлением этилена при 180 °C;
- по реакции хлорфосфатов с карбонильными соединениями в присутствии оснований;
- по реакции Тодда-Атертона;
- по реакции Перкова.
Органические фосфаты используются:
- как модификаторы пластмасс, повышающие огнестойкость;
- как экстрагенты урана, нептуния и плутония, редкоземельных элементов (трибутилфосфат, 2-этилгексилфосфаты);
- как флотореагенты, пестициды, лекарственные средства и др.