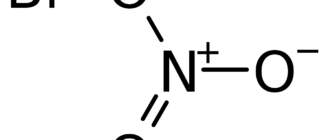Нитрат серебра(I) — неорганическое соединение, соль переходного металла серебра и неорганической азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, легко растворимые в воде. Весьма токсичен, как и все растворимые соли серебра. Не образует кристаллогидратов.
| Нитрат серебра | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат серебра(I) |
| Традиционные названия | Серебро азотнокислое; нитрат серебра; адский камень, ляпис |
| Хим. формула | AgNO3 |
| Рац. формула | AgNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 169,87 г/моль |
| Плотность | 4,352 |
| Термические свойства | Температура |
| • плавления | 209,7 |
| • разложения | 440 |
| Мол. теплоёмк. | 93,1 Дж/(моль·К) | Энтальпия |
| • образования | −124,4 кДж/моль |
| Химические свойства | Растворимость |
| • в воде | 122,2 (0 °C); 222,5 (20 °C); 373 (40 °C); 912 (100 °C) |
| Оптические свойства | |
| Показатель преломления | 1,744 |
| Классификация | |
| Рег. номер CAS | 7761-88-8 |
| PubChem | 24470 |
| Рег. номер EINECS | 231-853-9 |
| SMILES |
[N+](=O)([O-])[O-].[Ag+]
|
| InChI |
1S/Ag.NO3/c;2-1(3)4/q+1;-1
SQGYOTSLMSWVJD-UHFFFAOYSA-N
|
| RTECS | VW4725000 |
| ChEBI | 32130 |
| Номер ООН | 1493 |
| ChemSpider | 22878 |
| Безопасность | |
| Предельная концентрация | 0,5 мг/м³ (в воздухе) |
| ЛД50 |
20 мг/кг (собака, орально) 130 мг/кг (кролик, орально) |
| Токсичность | ядовит, коррозионно-активен |
| Пиктограммы СГС |     |
| NFPA 704 |
|
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:
- .
Этот способ применяют и в промышленности, используют рудное или вторичное серебро с последующей кристаллизацией нитрата серебра из раствора.
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C, энтальпия плавления 12,1 кДж/моль. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Теплоёмкость 93,0 Дж/(моль·К). Энтальпия образования −124,5 кДж/моль. Энтропия 140,9 Дж/(моль·К) при 298 К.
Хорошо растворим в воде, растворимость 215,5 г/100 г при 20 °C; с ростом температуры растворимость растёт (471,4 г/100 г при 60 °C, 651,9 г/100 г при 80 °C), в присутствии азотной кислоты резко снижается.
Другие растворимости (при 20 °C): в метиловом спирте — 3,6 г/100 г; в этиловом спирте — 2,12 г/100 г; в ацетоне — 0,44 г/100 г; в пиридине — 33,6 г/100 г. Растворим в ацетонитриле.
Нитрат серебра(I) обладает жгуче-кислым вкусом.
При комнатной температуре образует кристаллы ромбической сингонии, пространственная группа Pbca, параметры ячейки a = 0,6995 нм, b = 0,7328 нм, c = 1,0118 нм, Z = 8, d = 4,35 г/см3. При температуре выше 159,5 °C переходит в кристаллы тригональной сингонии, параметры ячейки a = 0,6287 нм, α = 48,5°, Z = 2. Энтальпия полиморфного перехода 2,47 кДж/моль.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
- ,
Образует осадки с водными растворами бромидов, иодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
- .
- Реагирует с щёлочью с образованием оксида:
- в этаноле, при -50 °C, образуется гидроксид серебра
Применение
Нитрат серебра применяется:
- в гальванотехнике, производстве зеркал и неорганическом синтезе как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов, в производстве фотоэмульсий;
- в медицине, как средство для прижигания кожи и бактерицидное средство.
Использование в медицине

Пятна от нитрата серебра на коже
Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия, иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.
Особенности обращения, биологическое действие
- Нитрат серебра(I) в высоких концентрациях ядовит. Минимальная смертельная доза (ЛД50) для собак — 20 мг/кг, для кроликов — 130 мг/кг.
- ПДК нитрата серебра(I) в воздухе рабочей зоны — 0,5 мг/м³, ПДК в воде — 0,05 мг/дм³ (с обязательным контролем по ионам серебра).
- Класс опасности — 2 (вещества высокоопасные) согласно ГОСТ 12.1.007-76.
- Как и все нитраты, является сильным окислителем.
- Вещество коррозионно-активно, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Галерея
- Изображения нитрата серебра
-
-