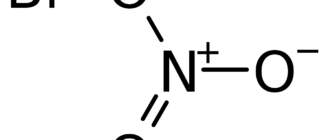Нитрат бериллия — химическое соединение с формулой Be(NO3)2. Представляет собой среднюю соль бериллия и азотной кислоты.
Соединение существует в виде кристаллогидратов различного состава, безводный нитрат не выделен. Из водных растворов при добавлении концентрированной HNO3 выделяется обычно тетрагидрат Be(NO3)2•4H2O4](NO3)2), кристаллы которого расплываются на воздухе. Известны также тригидрат Be(NO3)2•3H2O и дигидрат Be(NO3)2•2Н20.
| Нитрат бериллия | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат бериллия |
| Традиционные названия | Азотнокислый бериллий |
| Хим. формула | BeN2O6 |
| Рац. формула | Be(NO3)2 |
| Физические свойства | |
| Молярная масса | 133,021982 г/моль |
| Плотность | 1,56 г/см³ |
| Термические свойства | Температура |
| • плавления | 60 °C |
| • разложения | 100 °C | Энтальпия |
| • образования | -700,4 кДж/моль |
| Классификация | |
| Рег. номер CAS | 13597-99-4 |
| PubChem | 26126 |
| Рег. номер EINECS | 237-062-5 |
| SMILES |
[Be+2].[N+](=O)([O-])[O-].[N+](=O)([O-])[O-]
|
| InChI |
1S/Be.2NO3/c;2*2-1(3)4/q+2;2*-1
RFVVBBUVWAIIBT-UHFFFAOYSA-N
|
| Номер ООН | 2464 |
| ChemSpider | 24337 |
| Безопасность | |
| Токсичность | токсичен, ирритант |
Получение
Нитрат бериллия Be(NO3)2 можно получить в растворе взаимодействием оксида или гидроксида бериллия с азотной кислотой или обменной реакцией:
Физические свойства
Нитрат бериллия хорошо растворяется в воде и этиловом спирте. В водном растворе заметно гидролизуется. При 60°С кристаллы тетрагидрата плавятся в кристаллизационной воде, при 100°С начинается разложение соли.
Химические свойства
Вступает в большинство обменных реакций, свойственных другим нитратам. С карбонатами и сульфидами щелочных металлов и аммония реагирует с образованием гидроксида бериллия:
Нитрат бериллия в водных растворах частично гидролизируется с образованием основного нитрата:
При нагревании в вакууме возгоняется,образуя летучий оксонитрат:
Термическое разложение Be(NO3)2 происходит при 1000°С, при этом образуется оксид бериллия, кислород и оксиды азота:
Применение
Ранее, до начала повсеместного использования электрического освещения, нитрат бериллия использовался для изготовления колпачков газокалильных ламп, благодаря своей способности к термическому разложению с образованием оксида бериллия.
Токсикология
Нитрат бериллия весьма токсичен, как и многие другие соединения бериллия. Кроме того, он даже в малых дозах является раздражителем, вызывающим острую пневмонию.