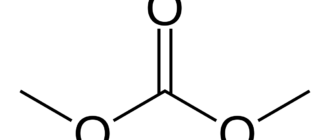
Этиленкарбонат — органическое соединение, сложный эфир угольной кислоты и этиленгликоля. Бесцветные кристаллы без запаха. Малотоксичен.
| Этиленкарбонат | |
|---|---|
| Общие | |
| Систематическое наименование |
1,3-Диоксолан-2-он |
| Традиционные названия | Этиленкарбонат; гликолькарбонат |
| Хим. формула | C3H4O3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 88,06 г/моль |
| Плотность | 1,3222 г/см³ |
| Поверхностное натяжение | 54500 Н/м |
| Термические свойства | Температура |
| • плавления | 38,5—39 °C |
| • кипения | 248 °C | Критическая точка |
| • температура | 500 °C |
| • давление | 6,2 МПа |
| Мол. теплоёмк. | 135 Дж/(моль·К) | Энтальпия |
| • плавления | 13,3 кДж/моль |
| Оптические свойства | |
| Показатель преломления | 1,419 |
| Структура | |
| Дипольный момент | 4,86 Д |
| Классификация | |
| Рег. номер CAS | 96-49-1 |
| PubChem | 7303 |
| Рег. номер EINECS | 202-510-0 |
| SMILES |
C1COC(=O)O1
|
| InChI |
1S/C3H4O3/c4-3-5-1-2-6-3/h1-2H2
KMTRUDSVKNLOMY-UHFFFAOYSA-N
|
| RTECS | FF9550000 |
| ChemSpider | 7030 |
| Безопасность | |
| Краткие характер. опасности (H) |
H318
|
| Меры предостор. (P) |
P280
|
| Сигнальное слово | Опасно |
| Пиктограммы СГС |    |
Получение
- Основным способом получения является взаимодействие этиленоксида с углекислым газом при температуре 150—200 °C и давлении 2—8 МПа в присутствии катализатора. В качестве последнего могут использовать галогениды щелочных металлов или тетраалкиламмония, бис-(трифенилфосфин)-никель:

- Конденсация этиленгликоля с различными производными угольной кислоты — диалкилкарбонатами, амидами, галогенангидридами и другими:
- Реакция этиленхлоргидрина с натриевой солью алкилкарбонатов или с концентрированными растворами неорганических карбонатов:
Физические свойства
Этиленкарбонат представляет собой бесцветные кристаллы без запаха. В жидком виде растворяет многие полимеры, полиэфирные волокна и смолы, к примеру, ПВХ, ацетат и нитрат целлюлозы, полиакрилонитрил, полиэтилентерефталат. Растворим в этаноле, диэтиловом эфире, ароматических углеводородах, ацетоне, карбоновых кислотах. Не растворим в сероуглероде, алифатических углеводородах, смешивается с водой в любых соотношениях, однако водные растворы этиленкарбоната неустойчивы вследствие гидролиза данного соединения. Нигигроскопичен.
Энтальпия плавления составляет 13,3 кДж/моль, энтальпия испарения равна 56,5 кДж/моль при 130 °C, энтальпия сгорания составляет -1171 кДж/моль.
| Температура, °C | 109 | 119 | 135 | 150 | 157 | 164 |
| Давление паров, кПа | 0,9 | 1,5 | 3,02 | 5,61 | 7,2 | 9,1 |
Химические свойства
По химическим свойства этиленкарбонат аналогичен пропиленкарбонату.
- Взаимодействует с нуклеофилами, при этом расщепляясь преимущественно по связи C—O:
- Каталитическое гидрирование приводит к этиленгликолю и метанолу:
- Гидролизуется с образованием этиленгликоля. Этот процесс ускоряется в присутствии кислот и щелочей:
- Может оксиалкилировать различные соединения, к примеру фенолы. Реакции подобного рода идут с хорошим выходом, если в смесь вводятся феноляты или карбонаты щелочных металлов:
- Медленно разлагается до окиси этилена при нагревании до 200—245 °C, в присутствии кислот и щелочей уже при температуре 125 °C:
Применение
Этиленкарбонат имеет важное практическое значение, так как благодаря своей малой токсичности и высокой диэлектрической проницаемости он используется в качестве апротонного растворителя полимеров в текстильной и химической промышленности. Мало влияет на разрыв цепей при полимеризации, что позволяет проводить в этиленкарбонате реакции полимеризации различных соединений.
Является экстрагентом ароматических углеводородов, а также исходным веществом для синтеза различных пластификаторов, модификаторов, полимеров, мономеров, средств защиты растений. В частности, путём хлорирования этиленкарбоната с последующим дегидрохлорированием триэтиламином синтезируют виниленкарбонат.