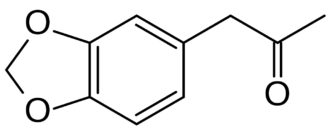
Ацетон — органическое вещество, имеющее формулу CH3—C(O)—CH3, простейший представитель насыщенных кетонов.
Применение
Ацетон применяется как сырьё для синтеза многих важных химических продуктов, таких как уксусный ангидрид, кетен, диацетоновый спирт, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан, изофорон, бисфенол А и так далее; пример:
Последний широко применяется при синтезе поликарбонатов, полиуретанов и эпоксидных смол.
Ацетон также является популярным растворителем. В частности он используется как растворитель
- в производстве лаков;
- в производстве взрывчатых веществ;
- в производстве лекарственных препаратов;
- в составе клея для киноплёнок как растворитель ацетата целлюлозы и целлулоида;
- компонент для очистки поверхностей в различных производственных процессах;
- как очиститель инструмента и поверхностей от монтажной пены — в аэрозольных баллонах.
Без ацетона невозможно хранить в компактном (сжиженном и в баллоне) состоянии ацетилен, который под давлением в чистом виде крайне взрывоопасен. Для этого используют ёмкости с пористым материалом, пропитанным ацетоном. 1 литр ацетона растворяет до 250 литров ацетилена.
Ацетон используется также при экстракции многих растительных веществ.
Лабораторное применение
В органической химии ацетон применяется в качестве полярного апротонного растворителя, в частности, в реакции алкилирования
для окисления спиртов в присутствии алкоголятов алюминия по Оппенауэру
Ацетон применяется для приготовления охлаждающих бань в смеси с «сухим льдом» и жидким аммиаком (охлаждает до температуры −78 °C).
В лабораториях используется для мытья химической посуды благодаря низкой цене, малой токсичности, высокой летучести и лёгкой растворимости в воде, а также для быстрой сушки посуды и неорганических веществ.
Очистка
Технический ацетон обычно содержит воду, иногда — спирт и другие восстановители. Проба на присутствие восстановителей:
К 10 мл ацетона прибавляют 1 каплю раствора перменганата калия (1:1000); после 15 мин. при 15° C не должно наблюдаться значительного посветления окраски.
Сушат ацетон безводным поташом (около 5 % от веса ацетона), нагревая смесь в течение нескольких часов с обратным холодильником, переливают в другую колбу и перегоняют над свежим осушителем. Металлический натрий и щёлочи непригодны для сушки ацетона.
Для использования в качестве растворителя при окислении органических веществ перманганатом калия ацетон перегоняют в присутствии небольшого количества перманганата калия (до устойчивой фиолетовой окраски раствора), при этом для удаления воды добавляют безводный поташ.
Очень чистый ацетон получают разложением аддукта ацетона и бисульфита натрия либо продукта присоединения ацетона и иодистого натрия:
В 440 мл сухого свежеперегнанного ацетона растворяют при нагревании на водяной бане 100 г безводного иодистого натрия. Образующийся раствор охлаждают до –8° C и аддукт отделяют отсасыванием. При нагревании аддукт разлагается, освобождающийся ацетон отгоняют, сущат безводным хлористым кальцием и снова перегоняют, защищая от влаги воздуха.
Обнаружение
В химико-токсикологическом анализе для обнаружения ацетона применяют реакции с растворами йода, нитропруссида натрия, фурфурола, ο-нитробензальдегида и метод микродиффузии.
Реакция на образование йодоформа.
При взаимодействии ацетона с раствором йода в щелочной среде образуется трииодметан (йодоформ):
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора аммиака и несколько капель раствора йода в йодиде калия (йодной настойки). В присутствии йода образуется желтый осадок трииодметана с характерным запахом, а его кристаллы имеют характерную гексалучевую форму. Предел обнаружения — 0,1 мг ацетона в пробе.
Реакция с нитропруссидом натрия (проба Легаля).
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску. При подкислении уксусной кислотой окраска переходит в красно-фиолетовую. Кетоны, в молекулах которых отсутствуют метильные группы, непосредственно связанные с кетоновыми (СО—) группами, не дают такой реакции. Соответственно такие кетоны как метилэтилкетон, метилпропилкетон и другие — также дадут красную окраску с нитропруссидом.
К 1 мл исследуемого раствора прибавляют 1 мл 10%-го раствора гидроксида натрия и 5 капель 1%-го свежеприготовленного раствора нитропруссида натрия. При наличии ацетона в пробе появляется красная или оранжево-красная окраска. При прибавлении 10%-го раствора уксусной кислоты до кислой реакции через несколько минут окраска переходит в красно-фиолетовую или вишнёво-красную. Следует заметить, что бутанон дает аналогичную окраску с нитропруссидом натрия.
Пожароопасность
Одна из основных опасностей при работе с ацетоном — его легкая воспламеняемость. Температура самовоспламенения +465 °C, температура вспышки −20 °C. Воздушные смеси, содержащие от 2,5 % до 12,8 % (по объёму), взрывоопасны. С этим необходимо считаться, так как ацетон быстро испаряется, и образующееся облако может распространиться до места воспламенения (нагрев или искра) вдали от места работы с ним.
Метаболизм
Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. Некоторое количество вещества выводится с выдыхаемым воздухом и выделениями кожи, некоторое — с мочой. В медицине ацетон относят к кетоновым телам. Нарушение нормального метаболизма, например, при сахарном диабете, приводит к так называемой ацетонурии — избыточному образованию и выведению ацетона.
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи — 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое — с мочой.
Токсикология, охрана труда
Ацетон токсичен. По данным ПДК ацетона составляет 200 мг/м3 (среднесменная за 8 часов) и 800 мг/м3 (максимально-разовая). По данным ряда исследований, например средний порог восприятия запаха был в ~3 раза выше чем максимально-разовая ПДК, и в ~12 раз выше среднесменной ПДК. При этом у части работников порог был значительно выше среднего значения (например, более 30 и 120 ПДК соответственно). В исследовании среднее значение порога восприятия запаха было ещё выше — 11 000 ppm (28 000 мг/м3), что превышает среднесменную ПДК в 140 раз.
Ацетон ядовит, но относится к малоопасным веществам (класс опасности IV, категория безопасности для здоровья по NFPA — 1). Сильно раздражает слизистые оболочки: длительное вдыхание больших концентраций паров приводит к возникновению воспаления слизистых оболочек, отёку лёгких и токсической пневмонии. Пары оказывают слабое наркотическое действие, сопровождаемое, чаще всего, дисфорией. При попадании внутрь вызывает состояние опьянения, сопровождаемое слабостью и головокружением, нередко — болями в животе; в существенных количествах возникает выраженная интоксикация, хотя, как правило, отравления ацетоном не смертельны. Возможно поражение печени (токсический гепатит), почек (уменьшение диуреза, появление крови и белка в моче) и коматозное состояние. При ингаляционном воздействии ацетон выводится гораздо медленнее (в течение нескольких часов), чем поступает, и поэтому может накапливаться в организме.
Государственный контроль
Ацетон, в концентрации более 60 %, в России входит в таблицу III спиcка IV «Перечня наркотических средств, психотропных веществ и их прекурсоров» и его оборот подлежит контролю. При работе в лаборатории с ацетоном, операции по его расходу должны вноситься в специальный «Журнал регистрации операций, при которых изменяется количество прекурсоров наркотических средств и психотропных веществ».