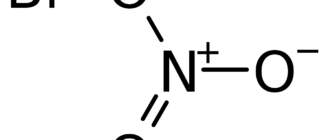Нитрáт желéза — соль азотной кислоты и двухвалентного железа.
| Нитрат железа (II) | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрат железа (II) |
| Хим. формула | FeN2O6 |
| Рац. формула | Fe(NO3)2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса |
(ангидрид) 179.854 г/моль (гексагидрат) 287.946 г/моль (нонагидрат) 341,992 г/моль |
| Термические свойства | Температура |
| • плавления | (гексагидрат) 60,5°C |
| Классификация | |
| Рег. номер CAS | 14013-86-6 |
| PubChem | 9815404 |
| SMILES |
[N+](=O)([O-])[O-].[N+](=O)([O-])[O-].[Fe+2]
|
| InChI |
1S/Fe.2NO3/c;2*2-1(3)4/q+2;2*-1
MVFCKEFYUDZOCX-UHFFFAOYSA-N
|
| RTECS | NO7175000 |
| ChemSpider | 7991154 и 32867051 |
| Безопасность | |
| NFPA 704 |
|
Физические свойства
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O — светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO3)2·9H2O.
График растворимости представлен на рисунке.
Особые точки:
| Состояние | Температура, °С | Концентрация, % |
| Лед+Fe(NO3)2·9H2O | -28 | (35) |
| Fe(NO3)2·9H2O+Fe(NO3)2·6H2O | ~-12 | (39) |
| Fe(NO3)2·6H2O | 60,5 | 62,5 |
Безводный нитрат железа (II) и его кристаллогидраты неустойчивы, поэтому легко окисляются на воздухе.
Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
Химические свойства
Проявляет восстановительные свойства. Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
- Реагирует с щелочами с образованием гидроксида железа (II):
- С растворимыми карбонатами дает белый карбонат железа(II):
- Восстанавливается до металлического железа при действии более активного металла :
- Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа(III)-калия (берлинская лазурь):
- При термическом разложении образуется оксид железа (III), а не оксид железа (II):