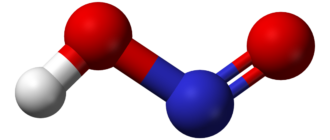
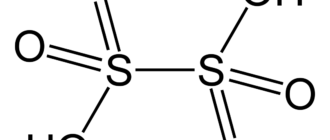
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных, безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
| Хлорная кислота | |
|---|---|
| Общие | |
| Систематическое наименование |
Хлорная кислота |
| Хим. формула | HClO4 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 100,46 г/моль |
| Плотность | 1,76 г/см³ |
| Термические свойства | Температура |
| • плавления | −102 °C |
| • кипения | 203 °C | Энтальпия |
| • образования | −40,4 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты
Соли хлорной кислоты называются перхлоратами. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном: Получение
Применение
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы. | |