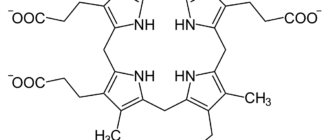
Гем С — вид гема, отличается от гема B наличием тиольных групп.
| Гем С | |
|---|---|
| Общие | |
| Хим. формула | C34H36FeN4O4S2 |
| Рац. формула | C34H36O4N4S2Fe |
| Физические свойства | |
| Молярная масса | 684,651 г/моль |
| Классификация | |
| Рег. номер CAS | 26598-29-8 |
| PubChem | 444125 |
| SMILES |
CC1=C(C2=CC3=NC(=CC4=C(C(=C([N-]4)C=C5C(=C(C(=N5)C=C1[N-]2)C)C(C)S)C)C(C)S)C(=C3CCC(=O)O)C)CCC(=O)O.[Fe+2]
|
| InChI |
1S/C34H38N4O4S2.Fe/c1-15-21(7-9-31(39)40)27-14-28-22(8-10-32(41)42)16(2)24(36-28)12-29-34(20(6)44)18(4)26(38-29)13-30-33(19(5)43)17(3)25(37-30)11-23(15)35-27;/h11-14,19-20H,7-10H2,1-6H3,(H6,35,36,37,38,39,40,41,42,43,44);/q;+2/p-2/t19-,20-;/m0./s1
XSWPXBWSKQRBRZ-FKLPMGAJSA-L
|
| ChEBI | 60562 |
| ChemSpider | 392105 и 26331983 |
| Безопасность | |
| NFPA 704 |
|
История
Точная структура гема С была опубликована в середине XX века шведским биохимиком К. Г. Паулем. Эта работа подтвердила верность формулы, предположенной ранее великим шведским биохимиком Хуго Теореллем. В 1975 году структура гема С была подтверждена экспериментально методами ядерного магнитного резонанса и инфракрасного излучения на восстановленной, Fe(II), форме гема. Впервые структура гема С, включая абсолютную стереохимическую конфигурацию тиоэфирных связей, была показана для белка позвоночного, а ныне и для многих других гем-С-содержащих белков.
Свойства
Гем С отличается от гема В тем, что два боковых винильных радикала заменены двумя ковалентными тиоэфирными связями с ферментом. Эти связи не позволяют ему так легко отсоединится от холопротеина или цитохрома с по сравнению с гемом В, который может отсоединится от гемопротеиновых комплексов даже при мягких условиях. Это делает возможным существование неизмеримо большого числа различных структур цитохромов, выполняющих различные функции, и работающих в основном как переносчики электронов.
Количество молекул гема С, присоединённых к одной молекуле белка достаточно широко варьирует. Для клеток позвоночных животных действует правило: один белок — один гем, но у бактерий обычно бывает 2, 4, 5, 6 или даже 16 гемов С на один холопротеин. Считается, что определённое количество и взаиморасположение гемов, не только связано с функциями белка, но и абсолютно необходимы. Например, белки содержащие несколько гемов С участвуют во множественном переносе электронов, особенно важной является реакция 6-ти электронного восстановления, необходимая для восстановления атмосферного азота до двух молекул аммиака. Для бактериальных гемопротеинов характерно высокое соотношение гемов С к аминокислотам, поэтому внутренняя часть некоторых цитохромов с часто оказываются полностью упакованной большим количеством групп гемов, по сравнению с обычными гемопротеинами. Некоторые из них, обычно из одноклеточных организмов, могут содержать до пяти гемов С. Ещё одним важным ферментом, содержащим гем С, является Коэнзим Q — цитохром c редуктаза.
Тиоэфирные связи, по-видимому, многократно увеличивают функциональность холопротеинов. Обычно цитохромы с можно «точно настроить» на большое количество окислительно-восстановительных потенциалов, чем цитохромы b. Возможно именно по этой причине цитохром с практически вездесущ на всех уровнях жизни. Гем С также играет важную роль в апоптозе клеток, когда всего несколько цитоплазматических молекул цитохрома с, содержащих гем С, приводят к программируемой смерти клеток.
Вдобавок к ковалентным связям, железо в геме С дополнительно координируется двумя аминокислотными цепями по 5-й и 6-й координационным связям,, что делает его шестикоординированным. Именно это позволяет железу в цитохроме менять свою валентность, в отличие от железа в гемоглобине, которое вне зависимости от присоединения или отдачи кислорода остаётся двухвалентным. Например, цитохром с млекопитающих и тунца содержит единственный гем С одновременно скоординированный цепями из гистидина и метионина. Возможно именно из-за двух ковалентных связей, удерживающих гем, железо в геме С иногда лигируется аминогруппой лизина или даже водой.