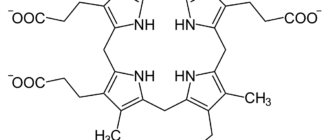
Гем а — вид гема, координационный комплекс макроциклического лиганда порфирина и атома железа.
| гем а | |
|---|---|
| Общие | |
| Традиционные названия | Железо-цитопорфирин IX, формилпорфирин |
| Хим. формула | C49H56O6N4Fe |
| Рац. формула | C49H56O6N4Fe |
| Физические свойства | |
| Молярная масса | 852.837 г/моль |
| Классификация | |
| Рег. номер CAS | 18535-39-2 |
| PubChem | 5288529 |
| SMILES |
C/C(C)=CCCC(C)=CCCC(C)=CCCC(O)c1c2/C=C3C (C)=C(C=C)/C=4/C=C8/C(/C)=C(/CCC(O)=O)C7=CC5C (CCC(O)=O)=C(C=O)/C6=C/c(c1C)n2[Fe-2]([N+]/3=4)(N56)N78
|
| InChI |
1S/C49H58N4O6.Fe/c1-9-34-31(6)39-25-45-49(46(55)18-12-17-30(5)16-11-15-29(4)14-10-13-28(2)3)33(8)40(52-45)24-44-37(27-54)36(20-22-48(58)59)43(53-44)26-42-35(19-21-47(56)57)32(7)38(51-42)23-41(34)50-39;/h9,13,15,17,23-27,46,55H,1,10-12,14,16,18-22H2,2-8H3,(H4,50,51,52,53,54,56,57,58,59);/q;+2/p-2/b29-15+,30-17+,38-23?,39-25?,40-24?,41-23?,42-26?,43-26?,44-24?,45-25?;/t46-;/m0./s1
ZGGYGTCPXNDTRV-YRJWGCQVSA-L
|
| ChEBI | 24479 |
| ChemSpider | 21106444 |
| Безопасность | |
| NFPA 704 |
|
Связь с другими гемами
Гем а отличается от гема В тем, что его боковая метильная цепь в восьмой позиции окислена до альдегидной группы, а гидроксиметилфарнезильная группа присоединена к боковой винильной цепи в позиции три. Гем а похож по строению на гем О: оба содержат фарнезеновый радикал в позиции три, но у гем а О нет альдегидной группы, вместо неё он сохраняет метильную. Точная структура гема а, основанная на исследовании восстановленного гема с Fe(II) методом ядерного магнитного резонанса и инфракрасной спектроскопии, была опубликована в 1975 году.
История
Гем а был впервые изолирован немецким биохимиком Отто Варбургом в 1951 году. Им же было доказано, что он является активным компонентом встроенного в мембрану металлопротеина цитохром c-оксидазы.
Стереохимия
До последнего времени вопрос о полной химической структуре гема а был не разрешён, до конца оставалось неясным геометрическое положения атома углерода в 3-й позиции кольца I. Недавно было опубликовано исследование, установившее его принадлежность к хиральной S-конфигурации.
Как и гем b, гем а обычно связан с аппопротеином через координационные связи между гемом железа и боковыми цепочками аминокислот. Он содержится в гемоглобине, миоглобине, а также в важном ферменте дыхательной цепи — цитохром с-оксидазе.

Гем а в цитохром-оксидазе с(ЦСО) крепится двумя боковыми гистидиновыми цепочками (показаны розовым)
Примером металлопротеина, содержащего гем а, является цитохром с-оксидаза. Этот очень сложный белок содержит гем а на двух сайтах, выполняющих различные функции. Железо гема а в цитохроме а шестикоординированно, поскольку связано с шестью другими атомами, а в цитохроме а3 оно соединено только с пятью атомами, что делает шестую связь доступной для связывания с молекулярным кислородом. Кроме того, фермент несёт на себе три иона меди и несколько ионов калия и натрия. Полагают, что оба гема А в ЦСО с лёгкостью обмениваются электронами между собой, а также с ионами меди и близко расположенным цитохромом с.
Согласно современным представлением две формильные группы и изопреноидная боковая цепь играют важную роль в сохранении энергии восстановления кислорода цитохром с-оксидазой. ЦСО, по-видимому, ответственна за сохранение этой энергии и перекачку протонов во внутримитохондриальное пространство.