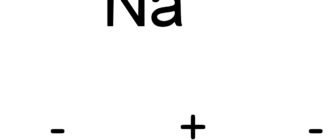Азотистоводородная кислота, азоимид, HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная ядовитая жидкость с резким запахом.Очень токсична. Её хорошо растворимые соли тоже очень ядовиты. Механизм токсичности аналогичен цианидам.
| Азотистоводородная кислота | |
|---|---|
| Общие | |
| Систематическое наименование |
Азидоводород, азотистоводородная кислота |
| Традиционные названия | Азоимид |
| Хим. формула | HN3 |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 43,03 г/моль |
| Плотность | 1,09 г/см³ |
| Термические свойства | Температура |
| • плавления | −80 °C |
| • кипения | 37 °C |
| Химические свойства | |
| Константа диссоциации кислоты
Кислота HN3 является окислителем. При взаимодействии с металлами образует соль металла, азот и аммиак: Соли этой кислоты называются азидами. При ударе или нагревании они распадаются со взрывом, на чём основано применение азида свинца Pb(N3)2 в качестве инициирующего взрывчатого вещества. Относительно устойчивы ионные азиды щелочных металлов, за исключением LiN3. Смесь HN3 и соляной кислоты HCl подобно «царской водке» является сильным окислителем из-за образующегося хлора и растворяет золото и платину: Кислота и её соли разлагаются при действии сильных окислителей с выделением азота. В органической химии применяется в реакции Шмидта. ПолучениеАзидоводород HN3 получают действием ортофосфорной кислоты на азид натрия NaN3, который синтезируют из амида натрия: Также азидоводород можно получить:
Токсичность
LD50 для мышей в воздухе 34 мг/м3, LD50 для мышей перорально — 33 мг/кг массы тела. | |