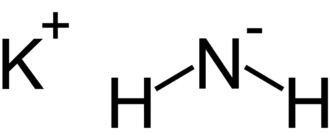
Амид натрия — неорганическое вещество с формулой NaNH2, производное аммиака. Представляет собой твёрдое вещество, которое реагирует с водой. Применяется в органическом синтезе.
| Амид натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
Амид натрия |
| Хим. формула | NaNH2 |
| Рац. формула | NaNH2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 39,01244 г/моль |
| Плотность | 1.37 г/см³ |
| Термические свойства | Температура |
| • плавления | 210 °C |
| • кипения | 400 °C |
| • разложения | 500 °C |
| Уд. теплоёмк. | 66,15 Дж/(кг·К) | Энтальпия |
| • образования | -118,8 кДж/моль |
| Классификация | |
| Рег. номер CAS | 7782-92-5 |
| PubChem | 24533 |
| Рег. номер EINECS | 231-971-0 |
| SMILES |
[NH2-].[Na+]
|
| InChI |
1S/H2N.Na/h1H2;/q-1;+1
ODZPKZBBUMBTMG-UHFFFAOYSA-N
|
| Номер ООН | 1390 |
| ChemSpider | 22940 и 21111834 |
| Безопасность | |
| NFPA 704 |
|
Описание
Амид натрия NaNH2 представляет собой белое кристаллическое вещество. Технические образцы имеют серый цвет из-за присутствия небольших количеств металлического железа, оставшихся от производственного процесса. Амид натрия является неустойчивым веществом, сильным восстановителем и водоотнимающим веществом. При работе с амидом натрия следует проявлять осторожность.
Получение
- Реакция газообразного аммиака с металлическим натрием при температуре 350 °C:
- Реакция гидрида натрия с аммиаком при температуре 350 °C:
- Реакция оксида натрия с жидким аммиаком при температуре −50 °C:
Применение
Амид натрия NaNH2 применяется при синтезах цианида натрия NaCN, индиго C16H10N2O2, сульфидина, витамина А и других веществ. Также его применяют для синтеза азидов: NaNH2 + N2O → NaN3 + H2O.