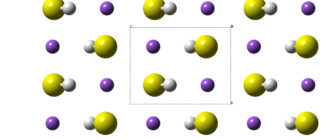
Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
| Сульфид калия | |
|---|---|
| Общие | |
| Систематическое наименование |
калия сульфид |
| Традиционные названия | калий сернистый, сульфид калия, калия моносульфид |
| Хим. формула | K2S |
| Физические свойства | |
| Состояние | бесцветный порошок с запахом тухлых яиц |
| Молярная масса | 110,262 г/моль |
| Плотность | 1,805 г/см³ |
| Термические свойства | Температура |
| • плавления | 471; 948 °C |
| Мол. теплоёмк. | 76,15 Дж/(моль·К) | Энтальпия |
| • образования | −387,3 кДж/моль |
| Химические свойства | Растворимость |
| • в воде | растворяется с образованием KSH, KOH |
| • в остальных веществах | растворяется в этаноле и глицерине |
| Структура | |
| Кристаллическая структура | кубическая сингония |
| Классификация | |
| Рег. номер CAS | 1312-73-8 |
| PubChem | 14800 |
| Рег. номер EINECS | 215-197-0 |
| SMILES |
[SH-].[K+].[K+]
|
| InChI |
1S/2K.H2S/h;;1H2/q2*+1;/p-1
FANSKVBLGRZAQA-UHFFFAOYSA-M
|
| RTECS | TT6000000 |
| ChemSpider | 14116 |
| Безопасность | |
| Пиктограммы ECB |   |
| NFPA 704 |
|
Физические свойства
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Получение
Прямой синтез из элементов:
Химические свойства
На воздухе медленно окисляется:
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Применение
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле
Сульфид калия образуется при сжигании пороха.