Нитрид плутония — бинарное неорганическое соединение азота и плутония с формулой PuN.
| Нитрид плутония | |
|---|---|
| Общие | |
| Систематическое наименование |
Нитрид плутония |
| Хим. формула | PuN |
| Физические свойства | |
| Молярная масса | 258,007 г/моль |
| Плотность | 14,35 г/см³ |
| Термические свойства | Температура |
| • плавления | с разложением 2589 °C |
| Мол. теплоёмк. | 50,2 Дж/(моль·К) | Энтальпия |
| • образования | -289,9 кДж/моль |
| Классификация | |
| Рег. номер CAS | 12033-54-4 |
Физические и химические свойства
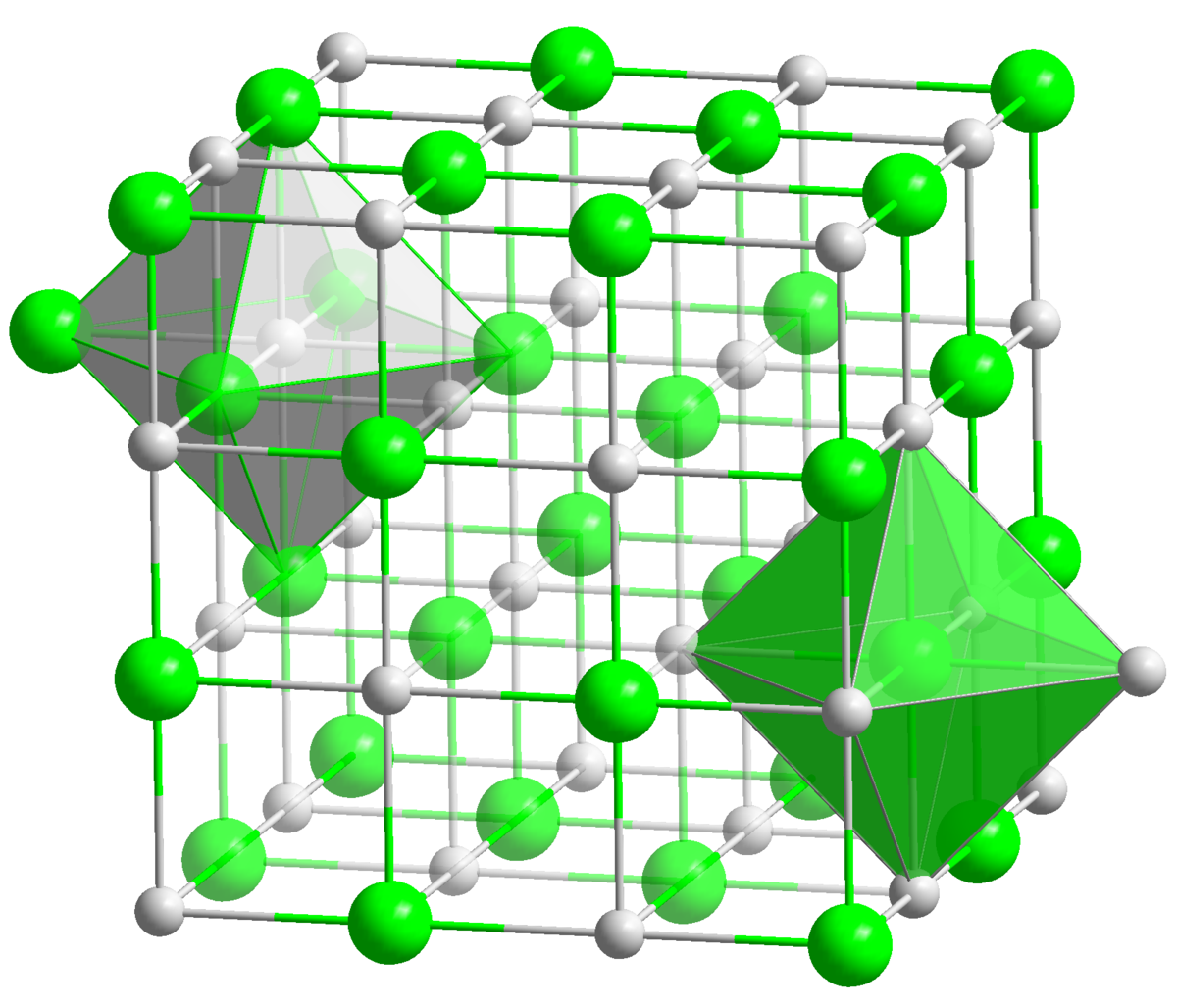
Нитрид плутония представляет собой кристаллическое соединение чёрного цвета. Кристаллическая решётка — гранецентрированная типа NaCl с параметрами a=0,4905 нм; z=4; пространственная группа Fm3m, однако вследствие радиоактивного распада плутония с испусканием α-лучей параметры кристаллической решётки со временем увеличиваются.
- ΔGo298(PuN) = −273,8 кДж/моль
- ΔSo298(PuN) = 67,7 Дж/моль·K
На воздухе нитрид плутония медленно окисляется до диоксида плутония. Порошкообразный нитрид плутония переходит в диоксид примерно за 1-3 суток, плотный окисляется значительно медленнее. Гидролиз нитрида плутония также приводит к диоксиду, в горячей воде гидролиз усиливается. При растворении в кислотах образуются соответствующие соли Pu(III), реакционноспособность кислот по отношению к нитриду плутония уменьшается в ряду HNO3 > HCl > H3PO4 > H2SO4, HF.
Получение и применение
Синтез нитрида плутония осуществляют по реакции гидридов плутония с азотом или аммиаком при температуре 650 °C и давлении 0,3 кПа. Нитрид плутония может быть использован в качестве топлива в ядерных реакторах.