- История
- Распространенность в природе
- Синтез карбонилов
- Прямое взаимодействие металла с оксидом углерода
- Восстановление солей металлов и их оксидов
- Фотолиз и термолиз
- Нуклеофильная атака по CO
- С электрофилами
- Разнообразие карбонилов и их химические формы
- Электронейтральные бинарные карбонилы металлов
- Анионные биядерные карбонильные комплексы металлов
- Катионные карбонильные комплексы металлов
- Гидриды карбонилов металлов
- Практическое применение
- Катализ
- Медицина и лекарственные средства
- Гетеролигандные комплексы карбонилов
- Нитрозильные комплексы
- Тиокарбонильные комплексы
- Фосфиновые комплексы
- Изоцианидные комплексы
- Токсикология
Карбонилы металлов — координационные комплексы переходных металлов с монооксидом углерода в качестве лиганда. Многие карбонилы металлов очень летучи. Находят применение в органическом синтезе, в качестве катализаторов для гомогенного катализа, например, при гидроформилировании или реакции Реппе. Карбонилы многих металлов, например, карбонил никеля, используются в процессе Монда для получения высокочистых металлов. В металлоорганической химии карбонилы металлов используются как прекурсоры для получения других металлоорганических комплексов.Карбонилы металлов ядовиты. При всасывании через неповреждённую кожу, вдыхании пыли или аэрозолей карбонилов, проглатывании, токсическое действие реализуется, в частности, из-за способности карбонилов карбонилировать гемоглобин с образованием карбоксигемоглобина, неспособного связывать О2.
История

Юстус фон Либих (1860)
Первые эксперименты по взаимодействию монооксида углерода с металлами были проведены Юстусом фон Либихом в 1834 году. Пропуская угарный газ над расплавленным калием он получил вещество, имеющее эмпирическую формулу KCO, которое он назвал Kohlenoxidkalium. Позднее было показано, что соединение было не карбонилом металла, а калиевой солью гексагидроксибензола и калиевой солью дигидроксиацетилена.
Синтез первого истинного гетеролептического карбонильного комплекса металла был выполнен Полем Шютценбергером в 1868. Пропусканием хлора и окиси углерода над платиновой чернью он получил дикарбонилдихлорплатину Pt(CO)2Cl2.
Людвиг Монд, один из основателей крупной химической компании Imperial Chemical Industries (ICI), исследовал в 1890-х годах вместе с Карлом Лангером (Carl Langer) и Фридрихом Квинке (Friedrich Quincke) различные процессы регенерации хлора, который расходовался в Солвэй-процессе, с помощью металлического никеля, его оксида и солей. В рамках своих экспериментов группа обрабатывала никель оксидом углерода, и было обнаружено, что образующийся газ окрашивал пламя бунзеновской горелки в зеленовато-желтый цвет, а при нагревании в стеклянной трубке образовывал никелевое зеркало. Газ может быть сконденсирован в бесцветную, прозрачную жидкость, с температурой кипения 43 °C. Таким образом, Монд и его коллеги обнаружили первый чистый, гомолептический карбонил металла — тетракарбонил никеля (Ni(CO)4). Необычайно высокая летучесть соединения металла (тетракарбонила никеля) была отмечена фразой лорда Кельвина о том, что Монд «дал металлам крылья».
В следующем году Монд и Марселен Бертло независимо открыли пентакарбонил железа, который производится по аналогичной методике, что и тетракарбонил никеля. Монд оценил экономический потенциал нового класса соединений, которые он коммерчески применил в процессе, позднее названном процессом Монда, и финансировал дополнительные исследования родственных соединений. Генрих Гиртц (Heinrich Hirtz) и его коллега М. Дальтон Ковап (M. Dalton Cowap) синтезировали карбонилы кобальта, молибдена, рутения, и впервые получили нонакарбонилдижелезо.
В 1906 году Джеймс Дьюар и Г. О. Джонс смогли определить структуру нонакарбонилдижелеза, которое образуется из пентакарбонила железа под действием солнечного света. После кончины Монда в 1909 году, химия карбонилов металлов в течение нескольких лет пребывала в забвении. В 1924 году компания BASF начала промышленное производство пентакарбонила железа по методу, который был разработан Алвином Митташем. Пентакарбонил железа использовался для производства железа высокой чистоты, так называемого карбонильного железа, и железнооксидного пигмента — охры. В 1927, А. Жоб и А. Кассаль получили гексакарбонил хрома и гексакарбонил вольфрама, новые гомолептические карбонилы металлов.
Уолтер Хибер несколько лет после 1928 играл решающую роль в развитии химии карбонилов металлов. Он проводил систематические исследования и открыл, в частности, основную реакцию Хибера (Hieber base reaction).
Некоторые карбонилы металлов реагируют с азидами, что даёт изоцианатные комплексы с выделением азота. Степень фрагментации можно контролировать регулируя напряжение на конусе и/или температуру. ESI-MS позволяет определить молекулярную массу исходного комплекса, а также информацию о структурных перестройках, связанных с потерей карбонильных лигандов.
Распространенность в природе
Для свободного гема гемоглобина человека в растворе сродство к CO превышает сродство к O2 в 20000 раз, что ставит под угрозу существование сложной жизни на Земле, однако белки гема — миоглобин и гемоглобин снижают селективность связывания, и отношение показателей селективности связывания CO к O2 составляет 25 к 200. Длительное время не удавалось установить причину этого эффекта. Например, для фрагмента Fe-C-O ранние рентгеноструктурные исследования показали неизвестное у карбонилов уголковое строение с углом 40-60˚. Лишь к концу XX века было установлено, что фрагмент практически линеен (с углом не более 7-9˚), причем линейная координация оказывается невыгодной из-за стерических затруднений, создаваемых белками окружения. Координированный O2, напротив, имеет уголковое строение, в котором терминальный атом кислорода образует стабилизирующую водородную связь с дальним гистидиновым остатком гемоглобина.
В исследованиях инфракрасного спектра Галактического Ядра в межзвездных пылевых облаках были обнаружены колебания CO, характерные для карбонилов железа. Кластеры карбонилов железа также наблюдались посредством ИК-спектроскопии в хондритах Jiange H5. Были найдены четыре ИК-частоты растяжения, характерные для терминальных и мостиковых карбонильных лигандов.
В богатой кислородом атмосфере Земли карбонилы металлов окисляются до оксидов. Но возможность образования таких комплексов в восстановительной гидротермальной среде в пре-биотическом периоде истории и возможность их участия в качестве катализаторов в синтезе критических биохимических соединений, например, пировиноградной кислоты, является предметом дискуссий. Следы карбонилов железа, никеля, вольфрама были найдены в газообразных эманациях осадков сточных вод муниципальных очистных сооружений.
Ферменты-гидрогеназы содержат молекулу СО, связанную с атомом железа. По-видимому, СО стабилизирует низкие степени окисления металла, что облегчает связывание водорода. Ферменты CO-дегидрогеназы и ацетил-КоА-синтазы также участвуют в биопревращениях СО. Некоторые CO-содержащие комплексы задействуются при отравлении угарным газом и выполняют сигнальную роль.
Синтез карбонилов
Синтез карбонилов металлов является предметом интенсивных исследований металлорганической химии. С момента опубликования работ Монда (Mond), а затем Хибера (Hieber), было разработано множество методов синтеза как моноядерных карбонилов металлов, так и гомо- и гетерометаллических карбонильных кластеров.
Прямое взаимодействие металла с оксидом углерода
Тетракарбонил никеля и пентакарбонил железа могут быть получены согласно следующим уравнениям реакций при взаимодействии тонкодисперсного металла с оксидом углерода:
-
- , (1 bar, 55 °C)
-
- , (100 bar, 175 °C)
Никель реагирует с монооксидом углерода уже при 80 °C при атмосферном давлении, а тонко измельчённое железо реагирует при температурах 150—200 °C и давлении моноксида углерода от 50 до 200 Бар. Карбонилы других металлов получают более сложным путём.
Восстановление солей металлов и их оксидов
Карбонилы некоторых металлов получают путём восстановления галогенидов металлов в присутствии моноокисида углерода под высоким давлением. Могут использоваться разнообразные восстановители, в том числе медь, алюминий, водород, а также алкилы металлов, например, триэтилалюминий. Показательным является образование гексакарбонила хрома из безводного хлорида хрома (III) в бензоле с алюминием в качестве восстанавливающего агента и хлоридом алюминия в качестве катализатора:
Использование алкилов металлов, например триэтилалюминия и диэтилцинка в качестве восстановителей приводит к окислительному сочетанию алкильных радикалов в димеры:
Соли вольфрама, молибдена, марганца и родия могут быть восстановлены с помощью литийалюминийгидрида. Гексакарбонилванадий получают используя натрий в качестве восстанавливающего агента в хелатирующих растворителях, например — диглиме.
В водной среде соли никеля или кобальта могут быть восстановлены, например, с помощью дитионита натрия. В присутствии CO соли кобальта количественно превращаются в тетракарбонилкобальт-анион:
Если используются оксиды металлов, то, в качестве продукта реакции, образуется диоксид углерода. При восстановлении хлоридов металлов монооксидом углерода образуется фосген, как, например, при получении хлорида карбонил-осмия из хлорида осмия. CO также подходит для восстановления сульфидов металлов, тогда побочным продуктом является карбонилсульфид.
Фотолиз и термолиз
Фотолиз или термолиз моноядерных карбонилов приводит к образованию двух- и полядерных карбонилов, как, например, нонакарбонилдижелезо (Fe2(CO)9). При дальнейшем нагревании карбонил разлагается в конечном счёте на свободный металл и монооксид углерода.
Нуклеофильная атака по CO
Обычно CO-лиганд легко подвергается нуклеофильной атаке. Например, триметиламин оксид и калия бис-(триметилсилил)амид преобразуют СО-лиганд в CO2 и CN—, соответственно. В основной реакции Хибера, гидроксид-ион атакует СО-лиганд с образованием металлокарбоксилата, с последующим выделением диоксида углерода и образованием гидрида металла или карбонилметаллата. Хорошо известным примером такого нуклеофильного присоединения является превращение пентакарбонила железа в H2Fe(CO)4:
Протонирование гидридоаниона даёт нейтральный тетракарбонил гидрид железа:
Добавление литийорганических реагентов к карбонилам металлов даёт ацилметаллические карбонильные анионы (комплексы Фишера). О — алкилирование этих анионов, например, солями Меервейна, даёт карбеновые комплексы переходных металлов (карбены Фишера).

С электрофилами
Несмотря на низкую формальную степень окисления, карбонилы металлов относительно инертны к действию многих электрофилов. Например, они устойчивы к действию алкилирующих агентов, слабых кислот, мягких окислителей. Большинство карбонилов металлов подвергается галогенированию. Пентакарбонил железа, например, образует карбонильные галогениды:
Галогены способны расщеплять связь металл-металл:
Разнообразие карбонилов и их химические формы
Большинство металл-карбонильных комплексов содержит смесь лигандов. Например исторически значимый комплекс Васка (транс-IrCl(CO)(PPh3)2) и антидетонационный агент метилциклопентадиенилтрикарбонил марганца (CH3C5H4)Mn(CO)3). Исходными соединениями для многих смешанных комплексов служат бинарные карбонилы, то есть отвечающие формуле [Mx(CO)n]z, многие из которых коммерчески доступны. Молекулярная формула многих карбонилов металлов может быть выведена исходя из 18-электронного правила.
Электронейтральные бинарные карбонилы металлов
- Карбонилы элементов 4 группы с 4 валентными электронами редки, но замещённые производные Ti(CO)7 известны.
- Карбонилы элементов 5 группы с 5 валентными электронами подвержены стерическим эффектам, которые препятствуют образованию М-М связей, как, например, в V2(CO)12, который неизвестен, хотя 17-электронный V(CO)6 известен и устойчив.
- Карбонилы элементов 6 группы с 6 валентными электронами образуют 18-электронные карбонильные комплексы Cr(CO)6, Mo(CO)6, W(CO)6. В металлорганическом синтезе для элементов 6 группы (как и для 7 группы) известен «цис эффект», заключающийся в лабилизации СО в цис-положении.
- Карбонилы элементов 7 группы с 7 валентными электронами образуют димеры карбонилов: Mn2(CO)10, Tc2(CO)10, и Re2(CO)10 (7 + 1 + 5 × 2 = 18 электронов).
- Карбонилы элементов 8 группы с 8 валентными электронами образуют карбонилы металлов
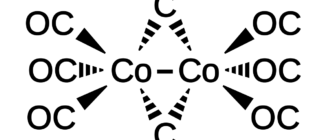
Fe(CO)5, Ru(CO)5 и Os(CO)5 (8 + 5 × 2 = 18 электронов). Последние два неустойчивы и склонны к декарбонилированию с образованием Ru3(CO)12, и Os3(CO)12. Так же известны два других карбонила железа: Fe2(CO)9 и Fe3(CO)12.
- Карбонилы элементов 9 группы с 9 валентными электронами, как и ожидается, образуют димеры карбонилов вида M2(CO)8. На практике устойчивыми оказываются только производные октакарбониладикобальта, но для всех трёх элементов 9 группы хорошо известны тетрамеры карбонилов: Co4(CO)12, додекакарбонил родия Rh4(CO)12, гексадекакарбонил родия Rh6(CO)16, и додекакарбонил иридия Ir4(CO)12 (9 + 3 + 3 × 2 = 18 электронов). В отличие от большинства 18-электронных карбонильных комплексов переходных металлов октакарбонилдикобальт Co2(CO)8 чувствителен к кислороду.
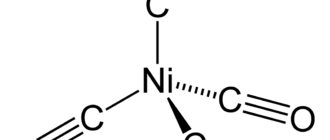
- Карбонилы элементов 10 группы с 10 валентными электронами образуют карбонилы вида Ni(CO)4 (10 + 4 × 2 = 18 электронов). Карбонилы Pd(CO)4 и Pt(CO)4 не являются стабильными.
Анионные биядерные карбонильные комплексы металлов
- Элементы 4 группы: дианионы карбонилов сходны с нейтральными производными карбонилов элементов 6 группы: [Ti(CO)6]2-.
- Элементы 5 группы: анионы сходны с нейтральными производными карбонилов элементов 6 группы: [Ti(CO)6]2-.
- Элементы 7 группы: моноанионы сходны с нейтральными производными карбонилов элементов 8 группы: [M(CO)5]— (M = Mn, Tc, Re).
- Элементы 8 группы: дианионы карбонилов сходны с нейтральными производными карбонилов элементов 10 группы: [M(CO)4]2- (M = Fe, Ru, Os). Конденсированные производные также известны.
- Элементы 9 группы: моноанионы карбонилов сходны с нейтральными производными карбонилов элементов 10 группы. Наиболее изученным является карбонил кобальта [Co(CO)4]—.
Также хорошо известны крупные анионные кластеры Ni, Pd и Pt.
Катионные карбонильные комплексы металлов
- Элементы 7 группы: монокатионы сходны с нейтральными производными карбонилов элементов 6 группы: [M(CO)6]+ (M = Mn, Tc, Re).
- Элементы 8 группы: бикатионы так же сходны с нейтральными производными карбонилов элементов 6 группы: [M(CO)6]2+ (M = Fe, Ru, Os).
Гидриды карбонилов металлов
| Гидрид карбонила металла | pKa |
|---|---|
| HCo(CO)4 | «сильная» |
| HCo(CO)3(P(OPh)3) | 5.0 |
| HCo(CO)3(PPh3) | 7.0 |
| HMn(CO)5 | 7.1 |
| H2Fe(CO)4 | 4.4, 14 |
| [HCo(dmgH)2PBu3] | 10.5 |
Карбонилы металлов способны образовывать комплексы с отрицательными степенями окисления, как, например, анионы, описанные выше. Эти анионы могут быть протонированы с образованием соответствующих гидридов карбонильных комплексов металлов. Нейтральные гидриды карбонилов металлов обычно летучи и могут проявлять кислые свойства (псевдогалогены).
Практическое применение
Карбонилы металлов используются в нескольких промышленных процессах. Возможно самым первым применением стало выделение и очистка никеля перегонкой его тетракарбонила (процесс Монда). Аналогично очень чистое порошковое железо получают термическим разложением пентакарбонила железа. Карбонил железа используется в частности для изготовления индукторов, красителей, диетических добавок, при производстве радиопоглощающих материалов для стелс-технологий и для создания металлопокрытий термораспылением.
Карбонилы металлов — хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые оксиды. Некоторые карбонилы используются для получения абсолютно чистого оксида углерода (II).
Катализ
Карбонилы металлов используются в ряде промышленно важных реакций карбонилирования. В оксо (анг. oxo) процессе олефин, водород и монооксид углерода совместно взаимодействуют с катализатором (например, октакарбонилом дикобальта), образуя альдегиды. Например, в производстве масляного альдегида (бутираля):
Бутиральдегид преобразуется в промышленном масштабе в 2-этилгексанол, предшественник пластификаторов ПВХ, с помощью альдольной конденсации, с последующим гидрированием полученного гидроксиальдегида. Оксоальдегиды, полученные гидроформилированием, используются для крупномасштабного синтеза жирных спиртов, которые являются предшественниками моющих средств. Гидроформилирование является высокоэкономной реакцией, особенно если процесс протекает с высокой региоселективностью.

Другой важной реакцией, катализируемой карбонилами металлов, является гидрокарбоксилирование (реакция Реппе). Ниже приведен пример синтеза акриловой кислоты и сложных эфиров акриловой кислоты:


Также реакция циклизации ацетилена в циклооктатетраен осуществляется с использованием металл-карбонильных катализаторов:

В процессах Монсанто и Кативы, уксусную кислоту получают из метанола, моноокида углерода и воды с помощью родиевого и иридиевого карбонильного катализатора в присутствии йодоводорода. Родственные реакции карбонилирования дают уксусный ангидрид.
Медицина и лекарственные средства
CO-выделяющие молекулы (СО-ВМ; англ. CO-releasing molecules, CO-RMs) представляют собой карбонильные комплексы металлов, которые разрабатываются в качестве потенциальных CO-выделяющих препаратов. При низких концентрациях угарный газ функционирует как сосудорасширяющее и противовоспалительное средство. CO-ВМ задуманы как стратегический фармакологический метод транспорта и доставки контролируемых количеств CO к тканям и органам.
Гетеролигандные комплексы карбонилов
Многие карбонилы, как известно, образуют гомолептические и смешанные комплексы, которые являются производными или аналогичны карбонилам металлов.
Нитрозильные комплексы
Нитрозильные комплексы металлов, включающие молекулу NO в качестве лиганда, многочисленны, хотя гомолептические производные неизвестны. По сравнению с CO, NO является сильным акцептором, а изоцианиды лучшими донорами. Известные нитрозильные карбонилы включают CoNO(CO)3 и Fe(NO)2(CO)2. Для нитрозильных комплексов так же известно два типа координации молекулы NO, в одном случае молекула линейна (резонансная структура NO+) и является донором трёх электронов, в другом имеет уголковое строение (резонансная структура NO—) и является донором одного электрона, тогда как молекула CO всегда является двухэлектроным донором. Как и CO, молекулы NO могут быть как терминальными, так и мостиковыми лигандами. Некоторые водорастворимые нитрозильные комплексы могут использоваться в качестве NO-содержащих лекарственных препаратов, например, при терапии солидных раковых опухолей.
Тиокарбонильные комплексы
Комплексы, содержащие CS (моносероуглерод), известны, но редки. Редкость таких комплексов отчасти обусловлена очевидной нестабильностью исходного соединения — моносульфида углерода. По этой причине синтез тиокарбонильных комплексов требует более сложных путей, как, например, взаимодействие тетракарбонилферрата натрия с тиофосгеном:
Комплексы, включающие CSe и CTe очень редки.
Фосфиновые комплексы
Все карбонилы металлов вступают в реакцию замещения карбонильных лигандов фосфорорганическими лигандами. Например, комплексы состава Fe(CO)5-x(PR3)x известны для х = 1, 2 и 3. PF3 ведёт себя аналогично, но примечателен способностью легко образовывать гомолептические аналоги биядерных карбонилов металлов. Например, летучие, устойчивые комплексы Fe(PF3)5 и Co2(PF3)8 представляют собой не содержащие CO аналоги Fe(CO)5 и Co2(CO)8 (не мостиковый изомер).
Изоцианидные комплексы
Изоцианиды также образуют обширные семейства смешанных комплексов с карбонилами металлов. Типичными изоцианидными лигандами являются метил- и трет-бутил изоцианид (Me3CNC). Особый случай представляет трифторметилизоцианид, нестабильные молекулы которого образуют устойчивые комплексы, физические и химические свойства которых весьма близко к поведению карбонилов металлов.
Токсикология
Все карбонилы являются ядовитыми веществами. Токсичность карбонилов металлов связана с токсичностью монооксида углерода и металла, и определяется летучестью и неустойчивостью комплексов. Попадание в организм происходит при вдыхании пыли или аэрозолей карбонилов, проглатывании жидких и твердых карбонилов, или при всасывании через кожу (ввиду хорошей растворимости карбонилов в жирах). Наибольший клинический опыт охватывает отравления карбонилом никеля и пентакарбонилом железа. Карбонил никеля считается одним из сильнейших ингаляционных ядов.
Вдыхание карбонила никеля вызывает острые неспецифические симптомы, сходные с отравлением угарным газом, в их числе тошнота, кашель, головные боли, лихорадка и головокружение. Через некоторое время появляются более тяжелые легочные симптомы — кашель, тахикардия, цианоз, или симптомы, связанные с желудочно-кишечным трактом. Кроме патологических изменений в легких, например, металлизации альвеол, наблюдаются повреждения мозга, печени, почек, надпочечников и селезёнки. Отравление карбонилами металлов обычно требует длительного периода восстановления организма. Хроническое воздействие при вдыхании низких концентраций карбонила никеля может вызвать неврологические симптомы, такие как бессонница, головные боли, головокружение и потеря памяти. Карбонил никеля считается канцерогеном, но может пройти от 20 до 30 лет от начала воздействия до клинических проявлений рака.