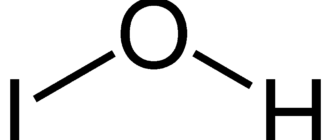
Иóдоводорóд — бесцветный удушливый газ, сильно дымит на воздухе. Хорошо растворим в воде, образует азеотропную смесь с Ткип 127 °C и концентрацией HI 57 %. Неустойчив, разлагается при 300 °C.
| Иодоводород | |
|---|---|
| Общие | |
| Систематическое наименование |
Иодоводород |
| Традиционные названия | Гидроиодид, иодистый водород |
| Хим. формула | HI |
| Рац. формула | HI |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 127.904 г/моль |
| Плотность | 2.85 г/мл (-47 °C) |
| Термические свойства | Температура |
| • плавления | –50.80 °C |
| • кипения | –35.36 °C |
| • разложения | 300 °C | Критическая точка | 150,7 °C | Энтальпия |
| • образования | 26,6 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты
В лаборатории HI можно получать с помощью окислительно-восстановительных реакций: HI способен восстанавливать концентрированную серную кислоту до сероводорода: Под действием света щелочные соли разлагаются, выделяя I2, придающий им жёлтую окраску. Иодиды получают взаимодействием иода со щелочами в присутствии восстановителей, не образующих твердых побочных продуктов: муравьиная кислота, формальдегид, гидразин: Замещает элементы в кислородных кислотах по реакциям Образующийся пентайодид фосфора гидролизуется водой. ПрименениеИодоводород используют в лабораториях как восстановитель во многих органических синтезах, а также для приготовления различных иодсодержащих соединений. Спирты, галогениды и кислоты восстанавливаются HI, давая алканы. При действии HI на пентозы он все их превращает во вторичный иодистый амил: CH3CH22CH2CHICH3, а гексозы — во вторичный иодистый н-гексил. Легче всего восстанавливаются иодпроизводные, некоторые хлорпроизводные не восстанавливаются вовсе. Третичные спирты восстанавливаются легче всего. Многоатомные спирты также реагируют в мягких условиях, часто давая вторичные иодалкилы. HI при нагреве диссоциирует на водород и I2, что позволяет получать водород с низкими энергетическими затратами. Физиологическое воздействие и токсикология
| |