Гидроксид никеля(II) — неорганическое соединение, гидроксид металла никеля с формулой Ni(OH)2, светло-зелёные кристаллы, не растворяется в воде, образует гидраты.
| Гидроксид никеля(II) | |
|---|---|
| Общие | |
| Систематическое наименование |
Гидроксид никеля(II) |
| Традиционные названия | Гидроокись никеля |
| Хим. формула | H2NiO2 |
| Рац. формула | Ni(OH)2 |
| Физические свойства | |
| Состояние | светло-зелёные кристаллы |
| Молярная масса | 92,70 г/моль |
| Плотность | 3,65; 4,1 г/см³ |
| Химические свойства | Растворимость |
| • в воде | 0,0005 г/100 мл |
| Классификация | |
| Рег. номер CAS | 12054-48-7 |
| PubChem | 61534 |
| Рег. номер EINECS | 235-008-5 |
| SMILES |
[Ni+2].[OH-].[OH-]
|
| InChI |
1S/Ni.2H2O/h;2*1H2/q+2;;/p-2
BFDHFSHZJLFAMC-UHFFFAOYSA-L
|
| RTECS | QR648000 |
| ChemSpider | 55452 и 21171180 |
| Безопасность | |
| NFPA 704 |
|
Получение
- Действие концентрированных щелочей на раствор солей двухвалентного никеля:
Физические свойства
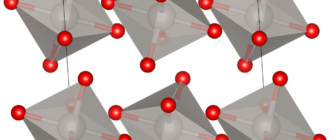
Гидроксид никеля(II) образует светло-зелёные кристаллы тригональной сингонии, пространственная группа P 3m1, параметры ячейки a = 0,3117 нм, c = 0,4595 нм, Z = 1.
Из раствора осаждается гидрат Ni(OH)2•n H2O из которого после сушки над серной кислотой выделяется соединение стехиометрического состава 3Ni(OH)2•2H2O.
Не растворяется в воде, р ПР = 13,80.
Химические свойства
- При нагревании разлагается:
- Реагирует с кислотами:
- Медленно реагирует с щелочами с образованием тетрагидроксоникелатов:
- С растворами аммиака образует комплексные аммины:
- Является слабым восстановителем: