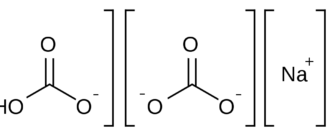
Гидрокарбонаты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3.Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты

Гидрокарбонаты щелочных металлов растворимы в воде. Также в воде хорошо растворимы гидрокарбонаты щёлочноземельных металлов, в отличие от карбонатов.
Получение
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- Пищевую соду (гидрокарбонат натрия) получают по так называемому аммиачно-хлоридному способу:
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
Химические свойства
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- Гидролиз гидрокарбонат-иона происходит по схеме:
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- С кислотами:
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливают временную жёсткость воды.
Физиологическое действие
В организме гидрокарбонаты являются буферными веществами, регулирующими постоянство реакции крови.